央广网北京8月5日消息 弥漫内生型脑桥胶质瘤(DIPG)是最常见的脑干胶质瘤,因位于桥脑内,呈弥散内生型生长,因此不易手术切除且现无有效治疗手段。该类肿瘤高发于儿童,两年生存率小于10%,对患儿家庭造成极大的心理伤害和经济负担。因此,DIPG一直是全球研究热点和难点。首都医科大学附属北京天坛医院张力伟教授团队一直致力于脑干胶质瘤的科学研究,推动脑干胶质瘤的精准诊疗。此前团队已取得多项国际性领先的科研成果:首次发现脑干胶质瘤PPM1D基因功能获得性突变(Nature Genetics 2014);开发脑干胶质瘤的脑脊液液体活检(Acta Neuropathologica 2019);完成迄今最全面的脑干胶质瘤多组学图谱整合研究(Nature Communications 2020)等,本研究是张力伟教授团队多年扎根脑干胶质瘤研究领域后的又一项重大突破。
2022年8月1日,国际顶尖学术期刊《Nature Cancer》在线发表了国家神经系统疾病临床医学研究中心/国家神经医学中心/首都医科大学附属北京天坛医院神经外科张力伟课题组与清华大学生命科学学院郗乔然课题组合作的科学研究。研究论文标题为"Context-dependent tumor suppressive BMP signaling in Diffuse Intrinsic Pontine Glioma regulates stemness through epigenetic regulation of CXXC5"。该研究系统性阐述了BMP信号通路在ACVR1野生型,H3.3K27M突变型DIPG中的抑癌作用,取得我国在世界范围内该肿瘤领域的重大成果。首都医科大学附属北京天坛医院张力伟教授、清华大学生命学院郗乔然副教授为论文的共同通讯作者。
在约80%的DIPG中,组蛋白H3.1K27M和H3.3K27M 突变是肿瘤发生的驱动因素。而其中H3.3K27M突变病人预后最差,H3.1K27M 突变病人则有相对更长的生存期,两个DIPG亚群同属一种肿瘤确有着不尽相同的致病机理和临床特征。北京天坛医院副院长、国家神经系统疾病临床医学研究中心副主任张力伟教授团队结合多年的临床和研究经验,与清华郗乔然教授团队合作,提出了分别研究这两个DIPG亚群的致病机制和潜在的创新治疗策略。
骨形态发育蛋白(BMP)信号通路会根据肿瘤微环境行使其抑制或促进肿瘤的作用。ACVR1突变与H3.1K27M突变造成BMP信号通路自激活,并共同促进约占比20%的DIPG亚群肿瘤的发展,但BMP信号通路对占比60%的ACVR1野生型,H3.3K27M突变型 DIPG亚群的影响仍未知。
张力伟教授介绍说,此项研究首次系统性地论述BMP信号通路在ACVR1野生型,H3.3K27M突变型弥漫内生型脑桥胶质瘤中的抑癌作用(图1)。首先,结合生物信息学分析技术和实验验证,研究人员发现在ACVR1野生型、H3.3K27M突变型DIPG中,高表达的BMP信号通路拮抗因子CHRDL1是造成其BMP信号通路异常下调的原因。高表达的CHRDL1不仅和不良预后正相关,而且实验证明CHRDL1是DIPG的促癌因子。下一步,研究人员重点探究了BMP信号通路在此DIPG亚群中发挥抑癌作用的分子机制:即激活BMP信号通路驱使此DIPG亚群退出干细胞状态,促进细胞分化,引起细胞周期停滞和细胞凋亡。并且,研究人员鉴定出BMP信号通路通过表观遗传调控下游靶基因CXXC5发挥抑癌作用。最后,通过药物筛选的方法,研究人员找到了可以激活此DIPG亚群中BMP信号通路并可能作为治疗DIPG的小分子药物——Dacinostat。
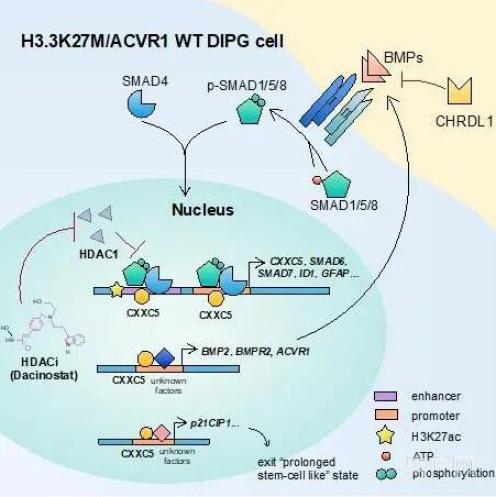
图1:BMP信号通路抑制H3.3K27M ACVR1 WT DIPG模式图
该研究不仅系统论述了BMP作为抑癌信号通路在弥漫内生型脑桥胶质瘤中的作用机制还报道了DIPG潜在的新型治疗药物靶点,为进一步揭示DIPG发生发展机制奠定了理论基础,为未来DIPG的药物筛选、开发新型治疗手段等提供了新思路。
依托国家神经疾病医学中心、国家神经系统疾病临床医学研究中心等重要平台,首都医科大学附属北京天坛医院神经外科将继续深入开展脑干和颅底肿瘤的基础及临床转化研究,不断推动脑肿瘤的精准治疗以最终惠及患者,实现脑科学、脑医学的长远综合发展。
转载申请事宜以及报告非法侵权行为,请联系我们:010-56807194
 长按二维码
长按二维码关注精彩内容





